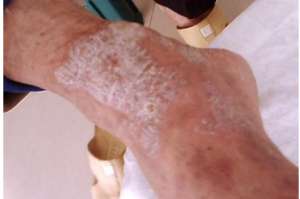
3 月 22 日,美国 FDA 核准 Taltz(ixekizumab)外科手术中的重度黑褐色锥状银屑病病人。银屑病是一种自体非典型皮肤上营养不良。在有银屑病家族史的病人中的,这种营养不良的愈演愈烈频率更高,通常肇始于 15 至 35 岁的人。最常见形式的银屑病是黑褐色锥状银屑病,这种营养不良病人会消失厚厚的白色皮肤上,有片锥状的淡黄色鳞屑。
「以前的核准为黑褐色锥状银屑病病人提供了另一种不可忽视的外科手术选择,可以借助加剧营养不良导致的皮肤上抑制及不适感,」FDA 抑制剂赞誉与研究中的心抑制剂赞誉 III 顶楼副校长、医学博士 Beitz 称。
Taltz 的活性成分是一种抗体(ixekizumab),它可以与一种能引起水肿的蛋白(白介素-17A)相结合。通过结合这种蛋白,Ixekizumab 能够抑制在黑褐色锥状银屑病拓展中的起起到的水肿反应会。Taltz 以注射剂使用。该抑制剂适用于准备全身性外科手术(以口服或注射后通过血流的物质顺利进行外科手术)、光疗(紫外光外科手术)或两者都有的病人。
Taltz 的安全性及有效性基于三项随机、安慰剂对照临床试验,共计有 3866 名准备顺利进行全身性外科手术或光疗的黑褐色锥状银屑病病人。结果显示,Taltz 与安慰剂相比达到了更高的响应,根据皮肤上银屑病病变的以往、物理性质及致使度顺利进行评分,Taltz 外科手术病人的皮肤上获得去除或基本上去除。
由于 Taltz 是一种影响免疫系统的抑制剂,该抑制剂的说明书告知病人他们可能有较大的感染、皮肤病或自身免疫营养不良风险。致使哮喘及水肿性肠病拓展或急转直下在 Taltz 的使用中的仅有报道。最常见的副起到除此以外上呼吸道感染、注射部位反应会及真菌感染。Taltz 由印第安纳州的礼来公司母公司销售。
查看信源地址
编辑: 冯志华- 2022-04-25BMJ:阿托伐他汀对ICU新冠肺炎重症患者预后的影响
- 2022-04-25小孩子有是什么症状
- 2022-04-13谁说生不出娃娃 是女人的错!?
- 2022-04-12按摩结石有用吗?
- 2022-04-11运动或帮助保护1型糖尿病患者β细胞功能
- 2022-04-11FDA批准塞尔基因Otezla治疗银屑病性关节炎
- 解析牛皮癣真的会遗传
- 硫磺皂对牛皮癣的作用治疗效果并不好
- 牛皮癣都有哪些治疗的办法呢
- 牛皮癣的遗传规律是什么
- 牛皮癣的症状治疗牛皮癣
- 牛皮癣的危害及预防方法有哪些
- 牛皮癣病情反复需防止外伤
- 牛皮癣治多久能有效呢
- 牛皮癣是怎么产生的
- 牛皮癣患者莫要乱投医
- 牛皮癣奇痒难忍该怎么办呢
- 牛皮癣吃花生可以吗
- 牛皮癣关节炎吃中药能行吗需要忌口吗
- 牛皮癣不发展还需巩固治疗
- 治疗牛皮癣偏方都有哪些
- 是什么原因导致牛皮癣
- 成人牛皮癣如何治疗好
- 引发关节型牛皮癣的病因具体有哪些
- 寻常型牛皮癣吃什么药物
- 大量食辛辣食物可能诱发牛皮癣
- 可以缓解牛皮癣症状的几个时间段
- 儿童牛皮癣怎么治呢
- 不要让你的拖延症拖跨牛皮癣
- 谁说生不出娃娃 是女人的错!?
- 按摩结石有用吗?
- 运动或帮助保护1型糖尿病患者β细胞功能
- FDA批准塞尔基因Otezla治疗银屑病性关节炎
- 银屑病药物 Brodalumab 自杀倾向副作用AZ 遭受重创
- 诺华银屑病药物 Secukinumab 比依那西普好
- 银屑病常用药物进入医疗保险,有效减轻患者的医疗负担
- 溢液是怎么回事?
- 必须走出移动医疗「只圈地 轻盈利」怪圈
- Neurology CP:1例巨细胞动脉炎
- 检查结节、囊肿的你,是不是彻夜不眠?
- 的预防
- 性激素六项试验单的含义是什么?
- 半年无业绩 国药控股先后出让投资公司75%股份
- Int J Impot Res:评估早泄患者口服药物的安全性和效果
- B正确打开超检单的方法!医生如何判断疾病?
- 上海国际男科研讨会